Оглавление:
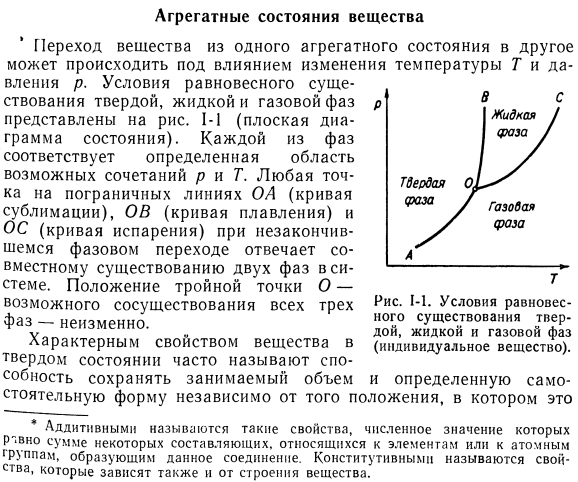




Агрегатные состояния вещества.
Агрегатные состояния вещества. На переход вещества из одного агрегатного состояния в другое влияет изменение температуры T и давления p. это переход вещества из одного агрегатного состояния в другое. Условия равновесия твердой, жидкой и газовой фаз показаны на рисунке. S (плоская диаграмма состояния).Каждая фаза соответствует определенной области P и T возможных комбинаций. Любая точка на границе OA (кривая сублимации), OB (кривая плавления) и OS (кривая испарения) при непрерывном фазовом переходе соответствует совместному существованию двух фаз в системе. Положение тройной точки O (возможность сосуществования всех 3-х фаз) остается неизменным. И Свойствами вещества в твердом состоянии часто называют способность поддерживать занимаемый объем в стабильном виде, независимо от его расположения.
Дополнительным свойством являются эти свойства, числовое значение которых равно p^, что равно сумме нескольких компонентов, относящихся к элементу или атомной группе, образующей данное соединение. Людмила Фирмаль
- Характеристики, которые также зависят от строения материи, называются конституциональными. Вещество находится. Однако переохлажденные жидкости в стеклообразном и пластическом состояниях обладают одинаковыми свойствами. Таким образом, порядок элементов, в которых построено вещество, например ионов, атомов, атомов или групп молекул в пространственной (кристаллической) решетке*, должен быть признан свойством твердого состояния. В реальных кристаллах твердых тел всегда наблюдается отклонение от идеальной структуры: в решетке появляются дефекты, включающие большое количество ее основных частей(макродефекты), либо ионы, атомы, молекулы (микродефекты) отсутствуют или дополнительно включены в решетку. Элементы, находящиеся в узлах пространственной решетки, непрерывно вибрируют. Амплитуда колебаний возрастает с увеличением температуры тела, при определенном значении последней (точка плавления Gpl) решетка разрушается, тело меняет агрегатное состояние и превращается в жидкость. О структуре жидкости известно мало.
- Подвижность жидкости указывает на то, что молекула может свободно перемещаться, а средний свободный путь молекулы очень мал. Из свойств удержания определенного объема следует сделать вывод, что между молекулами жидкости существует уравновешенная сила взаимного притяжения и отталкивания. Согласно исследованиям, расположение молекул в жидкости не хаотично, оно похоже на расположение молекул в кристаллической решетке, но гораздо менее точно и представляет собой довольно большое пространство, которое не заполнено молекулами. Некоторые свойства жидкости, например, температура кипения, зависят от размера этих пространств. В газовой фазе (газовой фазе) всегда есть несколько молекул одного и того же вещества, которые составляют жидкую фазу. Эти молекулы отделяются от поверхности жидкости, и концентрация в газовой фазе после достижения равновесия увеличивается с температурой(то есть давление пара жидкости увеличивается).Когда давление насыщенного пара равно внешнему давлению над поверхностью жидкости, начинается кипение.1 из характерных свойств жидкости является температура кипения под давлением 1 атм, которая называется нормальной температурой кипения ТМ. Если во время кипения жидкости повышается внешнее давление, то кипение следует остановить, а чтобы возобновить его, температуру следует поднять выше предыдущей.
Увеличение давления подавляет быстрое испарение только при температуре * Пространственная решетка имеет 4 основных типа: ионы, молекулы, атомы и металлы. Ниже критической ТКР. Эта температура соответствует критическому давлению (pkr) паров жидкости. Людмила Фирмаль
- При этих условиях 1 моль жидкости выводится из организма УмкрРис. 1-2, координаты P — V-T представляют собой пространственную модель бинарной системы жидкость-пар. Различные состояния системы представляют собой определенные точки на поверхности АОКЗЕВСА. Здесь несколько Изотерм, таких как RAVE, KCN, # 5 и т. д. также строятся графики. Точки области Ai KS соответствуют жидкостям, а область BCNE-парам*. Кривые кипения и конденсации as изолируют поле жидкости, в то время как кривые насыщенного пара CB изолируют поле пара от области ASB сосуществования жидкости и пара. Пункт С имеет важное значение. Изотерма KSY, где нет жидкой фазы в области KSM8K, является границей. Чем выше температура, то есть чем больше расстояние от критической изотермы KSY в направлении # 5, тем ближе изотермическая форма идеального газа. Кривая DIA называется граничной кривой. Точка кипения находится на ветке as, а точка росы на ветке NE. Если переход из одного агрегатного состояния в другое происходит на пересечении критических Изотерм между точками K и C. интерфейс не образуется. То есть, вы можете изменить жидкость на пар, или пар на жидкость непрерывно. Это обстоятельство доказывает, что агрегатные состояния жидкостей и газов очень далеки друг от друга
Смотрите также:
Возможно эти страницы вам будут полезны:
