Оглавление:







Алюминий
- Химические характеристики алюминия алюминий. 2-й тип Химический элемент III группы периодической системы-алюминий Первый и самый светлый металл sp с электронным is22s22p63s23p. In По сравнению с Бором, атомный радиус больше и потенциал ионизации Меньше, поэтому свойства металла улучшаются. В отличие от Неметаллический алюминий Бора является широким амфотерным элементом Слова.
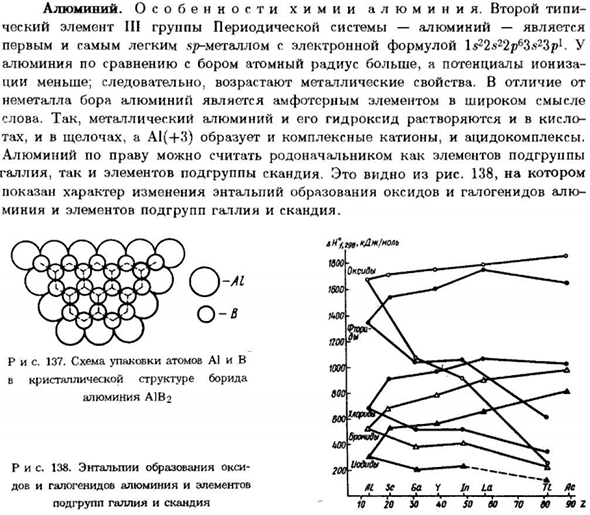
- Таким образом, металлический алюминий и его гидроксиды растворяются в кислоте. Наиболее крупные, как в щелочи, так и в А1(+3) образуют как комплексные катионы, так и кислотные комплексы. Это видно из рисунка. Сто тридцать восемь Показаны свойства изменения энтальпии оксида алюминия и образования галогенидов Элементы миниатюр и подгрупп галлия и скандия. Рисунок 137.
Алюминий можно считать предком элементов подгруппы Элементы подгрупп галлия и скандия. Людмила Фирмаль
Схема упаковки атомов A1 и B Кристаллическая структура борида A1B2 алюминия Рисунок 138.Энтальпия образования оксида Алюминий и галогенид алюминия и элементы Подгруппы галлия и скандия 20 И * 0 ТАК 80 70 ВТ 90% Алюминий очень важен для химии и своего большого Сродство к кислороду. Для сравнения, энтальпия и энергия приведены ниже. Отличительный оксид алюминия и Гиббсовское образование элементов подгрупп пы галлий: Смесь А12О3 Ga2O3 in2o3 с T12O3 Альфф 298> кДж / моль-1675.7-1089.1-925.9-390.4 АГ°/ 298,кДж / моль −1582.4 −998.3-831.8 −321.3
Как энтальпия образования алюминия, так и энергия Гиббса、 Для галлия и его аналогов. Скандий и металлы подгруппы Ланса только нет, значение этих характеристик даже больше, чем у алюминия. Наконец, для алюминия существует горизонтальное сходство со 2-м Типичным элементом группы IV является Silicon. It это понятно Алюмосиликаты наиболее распространены в земной коре Химическое соединение.
К ним относятся полевой шпат, который составляет Более половины массы земной коры, глинистых минералов, слюды и др. Силикат[Сио ^ 4″, который является частью кремний-кислородного тетраэдра, заменяется глинозема Нативный тетраэдр[AlOJ5 ″ — избыточное возникновение от этой замены Поскольку отрицательный заряд компенсируется ионами K +и Na +, электроны- Экзогенность алюмосиликата сохраняется. Производство алюминия с использованием природных соединений.
Алюминий является одним из 1 самых распространенных элементов на Земле(8,8%). Он занимает 3-е место по распространенности уступая только кислороду и Silicon. So … Таким образом, алюминий является наиболее распространенным металлом. Другой Алюмосиликаты в природе являются KA1 (SO4J ’ 2A1 (OHK (alunite)、 Na3 AlF6, Mg Al2O4 и форма оксидов и их гидратов Нью-йоркские бланки. Это в основном Корунд o ^ — A12O3.
В зависимости от содержания Мезей Корунд отличается по цвету и соответственно название бесцветное Нью-Йорк-Луко сапфир, синий сапфир, рубин красный рубин. Из гидратов Для глинозема обратите внимание на Боксит A12O3-pH2O, который содержит примеси оксида. Кремния, железа, титана и др. в зависимости от минералогической формы бокса、
Благодаря этому и содержанию связанной воды различают гидраргит A12Oz-ZN2O и диаспору A12oz ’ 2H2O. Боксит — самая ценная алюминиевая руда Более 50% A12O3. Первая стадия производства алюминия-А12О3 (глина Щелочная, кислотная, электротермическая или из алюминиевой руды (Земля) Комбинированный method. In вторая стадия, глинозем электролизуется Криолит плавится при температуре около 950°С. Криолит Натуральное, в большинстве случаев, приобретается artificially.
Do не считают Действие растворителя и оксида алюминия может представлять собой ионизацию в расплаве Уравнение А12О3 * = * АУ + + АУг Катод-это дно железной ванны, а анод-это углерод electrode. To Алюминий выпускается в катод. Заю * + Зе » = А1 + А12О3 Алюминат-ионы испускаются на аноде: 2Ayug-2- = А12О3+7гО2 Из-за выделения кислорода на аноде, уголь будет постепенно выгорать, но анод будет Он должен расти с перерывами.
Несмотря на высокую энергоемкость электроэнергии Лизинговый процесс, в настоящее время единственная отрасль Способ получения алюминия. Полученный электролитический алюминий составляет 98,5-99,8 от основного% Вещество. Примеси поглощены в утюге, меди, Титане, кремнии, и механически Получают при кристаллизации криолит, глинозем, древесный уголь.
Первый сырой металл После переплава его подвергают электрохимической очистке Лава из алюминия, фторида натрия и хлорида бария. Для того чтобы очистить Чистота алюминия достигает 99,9%.Нам нужен алюминий высокой чистоты. Например, в электронной технике вы получите специальный метод: вакуум Дистилляция и зонная плавка. Физико-химические свойства алюминия. Алюминий-серебристо-белый металл. кристаллизуются в ГЦК структуре. Отличный.
Характеризуется высокой пластичностью, прокаткой, штамповкой、 Ню алюминий-4-й в электропроводность Медь, серебро и золото. Алюминиевый металл является слабым парамагнитным. Алюминий химически активен, но на воздухе его лучше всего покрывать Е-10 Нм) оксидная пленка, надежно защищающая металл от дальнейшего окисления.
Это связано с электрически и механически прочной защитной пленкой В нормальных условиях E°(A13 + / A1)= −1.67 В, но A1 достаточно инертен. При температуре плавления алюминия при 660 ° с гранулированный А1 не будет плавиться. Даже при нагревании до 1200°C каждая капля слитков и металла плавится Оказывается, он находится в мешке с оксидами. Поэтому почти все реакции задействованы Алюминий имеет инкубационный период, необходимый для разрушения.
Диффузия оксидной пленки или реагента через нее. Алюминий обладает высоким взаимодействием с пуниктогеном и халькогеном Temperature. In в случае галогенов, за исключением йода, А1 реагирует при комнатной температуре. Temperature. In при наличии воды в качестве катализатора алюминий легко взаимодействует Он также работает с йодом. Потому что алюминий не взаимодействует непосредственно с водородом、 Хотя водород растворяется в it.
In нормальное состояние, A1-это Это вода, но легко растворимая в растворах кислот и щелочей. Я сосредоточен. Поскольку азотная кислота пассивирует алюминий, она не растворяется в алюминии. Характерные соединения. Характеристика Глинозем AI2O3 является важным соединением. Белый. Высоко тугоплавкие вещества ( 3000°C).Чисто AI2O3 регистрации Пиролиз квасцов: 2NH4A1 (SO4J =А12Оз + 2nh3 + 4so3 + Н2О Или гидроксид А1 (ОХК при 600-800°C.
In в последнем случае получается 7-AI2O3、 Это однонаправленно*при температурах выше 1000°C, нет.- А12О3. ф- А12оз химически сильно активен и hygroscopic. No глинозем * Монотропное преобразование-необратимый фазовый переход от 1 изменения Я не знаю. Он восстанавливается. Прокаленного AI2O3 не растворяется в воде. Он плавит.
Его состояние может быть преобразовано путем сплавления с щелочью или пирофосфатом. A12O3 + 2KOH = 2KAYU2 + H20 A12O3 + 3K2S2O = A12 (SO4K + 3K2SO4 При комнатной температуре глинозем практически не проводит электричество Это ток и диэлектрик. Начните при температуре выше 1000°C Он проводит значительный ток и проявляет полупроводниковые свойства.
При повышении температуры электропроводность возрастает экспоненциально. Но. В этих условиях кислород отключается при A12O3, и в результате Нарушает стехиометрический состав и приводит к электронной проводимости Мост. Гидроксид алюминия получают осаждением основаниями из раствора Натуральная соль (А1 (+3).Белый студенистый осадок, не окрашенный Похититель воды. Этот осадок является, по сути, полимерным продуктом.
Страна тригидрата гидроксида алюминия, растворенного в кислоте Щелочной: [A1(H2ON) с+ Зона АКОХВ ZN2O [А1(Н2О)с (О) С1 | В Осадки/ Я Один Я Зона [Аl (он)*!Три [А1(Н2О)З (О) Ы)» Кислотный и основной гидроксид алюминия, а также амфотерные электролиты Слабое выражение лица. Metaphome-наву2-NAYU2 Н3АЮ3 кислоты, соли называется- Металлический алюминий или алюминиевая шпинель, некоторые из них Он содержится в группе минералов, называемых естественными в природе (MgAl2O4, ZnAl2O4) Шпинель.
Это соли глинозема Оксиды металлов или карбонаты. Шпинель имеет кубическую решетку. Атомы кислорода образуют плотное заполнение Тетраэдрические и октаэдрические структуры шины The void. In так называемая норма Небольшой шпинели MgAl2O4, таких как、 В пустотах тетраэдра Атом Mg, и восьмигранный атом А1 (рис. 139). Обезвоженный, студенистый Гидроксид алюминия может быть получен эффективно Основной формой A12Oz является almogel.
It есть Очень разные вещества Внешне от обычных мелких кристаллов Порошок А12оз-альмогель не растет Он разрывается с водой и не надувается Эффективный осушитель воздуха. Также Альмогель-это хорошая карьера Многолюдно (в основном никель и платина). Ш-А1 Т-МД о-V 139. ни-кристаллическая структура Небольшой шпинель Среди характерных А1-3 галогенидов фториды существенно отличаются по своим характеристикам Он происходит от гомологов, содержащих энтальпии образования (см. Рисунок 138).
Точка плавления и Точка кипения. Были показаны необычно высокие значения Сравненный к другим галоидам, константа ALFG、 Ионная природа этого вещества по фтору Max OEO. В отличие от Других галогенидов алюминия практически нерастворимы в их фтора. В В результате гидролиза хлорида алюминия, бромида и иодида испаряются в воздухе.
В Пары, они существуют в виде димеров A ^ Gd с поперечной связью: Аль-А1 В димере галоида алюминия, c. h. 4.In кроме того, 4 ковалентные связи 3 связи, образованные обменным механизмом, и донор-акцептор- Это хорошая идея. А1 действует как акцептор электронной пары、 pa-атом галогена. Здесь тоже чувствуется аналогия диагоналей.
Он существует между алюминием и бериллием. Фторид алюминия синтезируется из элемента или воды- Алюминиевая сода в плавиковой кислоте. Комфортное A1C1z получается при нагревании. Низкий алюминий в подаче хлора или HCl, и проходить над heated хлором Смесь а12оз и угля. Бромид алюминия и йодид алюминия、 Нагрейте его.
Соединения с другими non-metals. In эфирный раствор Между литий-алюминиевым гидридом (тетрагидрофуруминатом) и хлоридом алюминия Реакция 3Li [AiH4] + AICI3 =4А1Н3+ 3LiCl протекает с образованием белого Осадок-полимер гидридный (А1Н3) га.3-мерная сетка структуры (зола) p — Мост соединения А1, ч. А1. Более 300 ° C、 Вы-мощная восстанавливающая сила, вода гидролизуется с выделением водорода- Лем.
- Гидрид алюминия имеет свободную орбиту 3p, поэтому он наклонен. Реакция присоединения, которая действует как акцептор электрона pair. So он При нагревании, совместить образование аммиака и гидрида ХСН-Ашз、 При температурах до 150°С он переходит в нитрид алюминия (A1N). С халькогеном алюминий образует соединение типа AI2X3.Они все синтетические.
Вакуумный кварц извлекают из компонентов в ампулах. Энтальпия изображения В результате он естественным образом уменьшается от сульфида до Теллурида Соотношение ионной природы химических связей между разнородными атомами. С Это соли слабых оснований и слабых кислот в водных растворах Он полностью гидролизуется. Эта реакция、 Чтобы получить соответствующий халькоген водорода.
Нитрид алюминия частично образуется при сгорании металла в воздухе、 Людмила Фирмаль
В очень малых пропорциях по отношению к оксидам. Их несколько. Сравнение способа изготовления А1Н: действие аммиака на нагретый металл, взаимодействие Действие азота и сульфида алюминия. Наконец, вы можете получить нитрид алюминия По реакции А12О3+ЗС + N2 5 = 2a1n + ЗСО Триста тридцать пять В начале нашего века эту реакцию предлагалось совместить с атмосферой Идите к азоту.
Интенсивно протекают при 1500-1600°С для поддержания высокой температуры Температура достаточна для теплотворной способности выделяемой окиси углерода. Нитрид алюминия имеет структуру вюрцита. При нагревании он начнет работать Он разлагается в 1900 году и плавится при температуре 4,04 * 10°C под давлением 1200 с ПА. Непал Переплавленный A1N также гидролизуется во влажной среде. После переплава Нитрид алюминия превосходен в химической устойчивости.
С остальными Минеральному алюминию (за исключением висмута) также дают эквационное соединение、 Температура плавления и тенденция гидролиза к снижению от фосфора Сурьма кормит. Все они перспективные полупроводники Соединение. При взаимодействии алюминия с углем при температуре 1800-2000 ° С в атмосфере водорода Да, существует синтетическая реакция карбида алюминия AI4C3 в бесцветной форме Прозрачные ромбоэдрические кристаллы.
Примеси станут желтыми Цвет.1. алюминиевый карбид является одним из немногих карбидов, чтобы соответствовать правилам. Формальная валентность. Галогенов и халькогенов сделать карбида алюминия Углерод. Также был получен карбид в составе A12Cb(ацетилен). Соли кислородсодержащих кислот и комплексов нью-йоркское соединение. Водонерастворимый AIPO4 делает его интересным Это кварцевая структура.
Это связано с горизонтальной аналогией, близостью Атомный радиус электрона, например Al, Si, P и т. д. Если вы представляете себе фосфаты алюминия Минимальное значение в виде Аюг-рога, а сумма диоксида кремния в виде SiO2-SiO2, то валентность Электроны атомов алюминия и фосфора равны 8, а число валентных электронов равно Кроме того, 2 из 8 атомов кремния равны, то есть. Именно сумма валентностей.
Алюминий и люминофор электронные. Водорастворимый нитрат А1 (Гтоз) 3 кристаллизуется из раствора 9. Водные молекулы. Безводный нитрат алюминия в концентрированной азотной кислоте Кислотный комплекс вызывает [A1 (GTozL]-но в воде он полностью разрушается. Жир А12 (SO4K) кристаллизуется в виде Al2 (SO4) s-I8H2O из водных растворов. Сульфат алюминия+1 сульфат в окисленном состоянии образует двойную форму Соль типа Me2SO4 «A12 (SO4K’ 24H2O. эти соединения называются квасцами.
Мини-квасцы. Квасцы в твердом состоянии очень устойчивы, но в растворе Он сильно диссоциирует с составляющими его ионами. Квасцы растворяются в воде. Гораздо хуже, чем составляющие сульфаты и поэтому менее подвержены воздействию Гидролиз. Однако раствор имеет кислую реакцию. Не только форма квасцов. А1(+3) , а также галлий и Indium.
In стол.23 последовательность ионов обоих типов слева направо и сверху Вниз соответствует снижению способности образовывать квасцы. Таблица 23.Способность элементов образовывать квасцы. Рубидий+ Цезий+ NH4 Н+ А13 + Ga3 + Fе3- Ый rh3 * В3 + 「* Со3 + + : Партнеров TI3 + -¦ Форм mn3 + + — — Триста тридцать шесть По понятным причинам, среди металлов s и sp алюминий является Лучший комплексообразователь.
Это также очевидно из того факта, что A1 (+3) лучше. Квасцы образуют другие катионы; в природе встречаются такие стабильные соединения Rex Na3 [AlF6] как криолит(pa’Nest 19.8).Дело в том, что характеристики Иона А13 + За большую плату, небольшую по размеру, пустую 3 секунды, 3 секунды и даже 3 < / — орбиты Ель. Благодаря сложной формообразующей способности s и sp элементов, в том числе алюминия Его можно сравнить только с диагональю beryllium.
In их совместное использование Динамическое соединение А13 +проявляет тенденцию к октаэдрам и тетраэдрам. Координация Хедрик. В дополнение к вышеуказанным Аква -, гидроксо и фтор к. комплекс с ч. 6 стабильный оксалатный комплекс[a ^ CrC ^ b] » pA ’ гнездо 13.0 и c. h. 4.Со всеми ионами галоида, А13 +r. it образует комплекс с ч. Четыре Среди них[AIF4]является наиболее стабильным («pACest 17.8).
Стабильность четыреххлористого комплексов[aifj от фтора к йоду естественно Она уменьшается. к. цианидные и роданидные комплексы С ch также известны. 4, демонтированный Он гигроскопичен и легко гидролизуется при длительном хранении. Металл chemistry. No металл в периодической системе Непрерывный твердый раствор не получается.
Алюминий-плохое решение. Особенно хорошо растворим в других металлах, но других металлических отходах Переходный. Для алюминия, большой Количество металлидов: включая литий, щелочноземельные и все переходные металлы Объединять. Как видно из диаграммы состояния A1 — Ni (рис. 140), алюминий и никель Рэм образует большую площадь твердого Альфа-раствора、 minia не имеет зон твердого тела solution.
In добавление, атом-металлид Айни плавится при значительно более высоких температурах, чем огнеупоры Компоненты-никель, особенно алюминий. Эта связь реальна. Это неудивительно, ведь в его основе лежит широкая однородная область. Это неправда. Сетка, алюминий и никель образуют ряд метаридов, которые плавятся в несоответствие. Только олово (или металл sp) обеспечено алюминием в диаграмме положения Простая эвтектика. Алюминиевый Действительно ли натрий взаимодействует с щелочью f°? Металлов, таллия、 Свинец и висмут.
Смотрите также:
| Подгруппа цинка | Подгруппа галлия |
| Бор | Подгруппа скандия и РЗЭ |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
