Оглавление:





Гидролиз солей
- Гидролиз солей Чтобы понять суть гидролиза солей, эмпирически определите соотношение между солью и водой в присутствии индикатора. Результаты экспериментов приведены в таблице 42.Потому что изменение цвета-это признак химической реакции (I, с. Как это объяснить? Таблица 42.
- Соотношение соли и воды Влияние солевого раствора на индикатор солевого раствора Лакмус фенол фталат метиловый оранжевый. Натрия хлорид хлорида алюминия, карбоната натрия цвет не изменит румяна голубоватым оттенком цвета, не меняет цвет, не меняет цвет, не меняет цвет, не меняет цвет, не меняет цвет, не меняет цвет, не меняет цвет, не меняет цвет, не меняет цвет, не меняет цвет, не меняет цвет не меняет Напомним, что главным условием протекания реакции обмена в конце является наличие комбинируемого Иона(стр. 14).
Кроме того, молекулы воды, хотя и незначительные, диссоциируют на ионы(стр. 11). Людмила Фирмаль
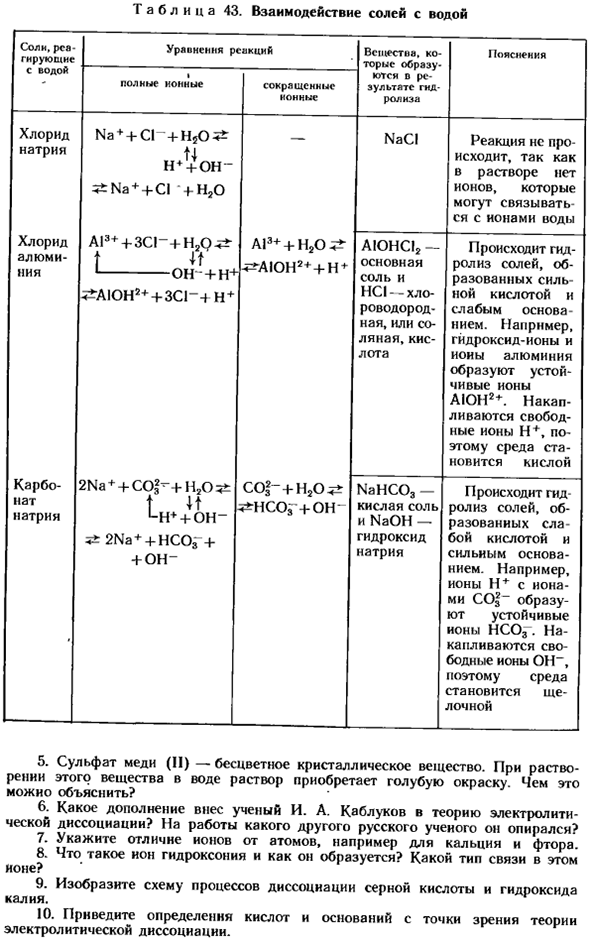
С учетом этого мы рассмотрим данные таблицы 43 О взаимодействии соли с водой. Экспериментальные результаты, представленные в таблице 43, дают ответ на поставленный выше вопрос. Соли, образованные сильными основаниями и сильными кислотами, не вступают в реакцию с водой. Соль образуется в воде, образованной либо слабым основанием и сильной кислотой, либо сильным основанием и слабой кислотой, либо слабым основанием и слабой кислотой.
Потому что эти соли содержат ионы, которые могут связываться с ионами воды. Обменная реакция некоторых солей с водой подразумевает реакцию гидролиза(от греч.«Гидро» — вода, «растворенный» — разлагается). Ответить. Выполните вопрос 22-23 (стр. 19). 1.It объясню, почему раствор сахара пропускает электрический ток. Раствор хлорида натрия проводит.
2.Приведите основные причины распада молекул того или иного вещества на ионы. 3.Сформулируйте основные положения теории электролитической диссоциации и объясните их. 4.Хлор, входящий в состав молекул хлорида натрия и соляной кислоты, не оказывает вредного воздействия на организм человека, а вдыхание небольшого количества хлорного газа вызывает удушье и повреждение органов дыхания.
Пожалуйста, объясните это явление. ^ _ Таблица 43.Взаимодействие соли с водой Соль заменяет реакцию на реальную жизнь УРА-на. Какой образ-Я(описание Использование воды * общее количество ионных восстановительных ионов в результате гидролиза Хлорид натрия Na + + CI n4 + on-Na ++ CI + H20 в растворе NaCI нет Иона, который может связываться с ионами воды, поэтому реакции не происходит.
Хлорид алюминия A13 ++ 3CI » + H2Q ^ t It 1-OH — + H ^ AIOH2 + + 3CI-4H + AI3 ++ H2O ^ A!0HCI2-основная соль, а HCl-соль, образованная соляной кислотой или соляной кислотой с сильной кислотой и слабым основанием, например, гидроксидные ионы и ионы алюминия образуют стабильный Ион AYUN2*. Карбонат натрия 2Na + — fCO| — +Н2 ± ± T и 2NA + + hcoj + + oh — c0l » + H20 ^ ♦Zhsog + oh NAHC03-кислотная соль и NaOH-гидроксид натрия например, со|〜ион, содержащий stable + Ион, стабильный нс03 ионы образуются.
5.Сульфат меди (II) представляет собой бесцветное кристаллическое вещество. Когда это вещество растворяется в воде, раствор становится синим. Как это можно объяснить? 6.Ученый И. А. какие дополнения кабульков внес в теорию электролитической диссоциации? На каких еще русских ученых он опирался? 7.It показывает разницу между ионами и атомами, такими как кальций и фтор. 8.Что такое гидроксоний Ион?
Какие соединения есть в этом Ионе? 9.Нарисуйте схему процесса диссоциации серной кислоты и гидроксида калия. 10.С точки зрения теории электролитической диссоциации, обозначим определение кислот и оснований. 11.Как гидроксид бария диссоциирует объясняется в соответствующем уравнении. 12.Создайте уравнение, соответствующее нормальному процессу диссоциации n-кислоты.
13.Исходя из понятия «степень диссоциации», мы опишем значение слов»сильная кислота»,»слабая кислота«. 14.Чем отличается понятие «степень диссоциации» между слабыми и сильными электролитами? 15.Раствор представляет собой: а) перманганат калия Кмп04. б)сульфат калия K2S04; с)najcrcv хромат натрия; г)сульфат меди (II)CuS04; д)хлорида никеля NiCl2.Как вы можете отличить эти решения и каковы причины этих признаков? 16.Ион Ag+, значит?-
Предварительно определенный раствор, содержащий, H+, 1〜.Как определить эти решения? Напишите уравнение соответствующей реакции. 17.Раствор представляет собой: а) сульфат цинка и нитрат бария. б) сульфат меди (II) и гидроксид калия. в) сульфат цинка и хлорид алюминия; г)хлорид магния и ортофосфат натрия; д) хлорид железа (III) и сульфат магния. Какой раствор слить, и метаболическая реакция будет последней?
Составьте уравнения для этих реакций в числителе, полном ионном и сокращенном виде. 18.Показана следующая схема. а)2H + + CO? — >- б)2Н + + С2-— c)2H + + Итак? «- Создайте соответствующее уравнение реакции в виде молекулы. 19.Подумайте об уравнении реакции.: * a)2H20 2H2t + 02t б)Си(0н)24-соединениях cu0 + Н20 в)Н2О + Н20 2HN03 d)CuS04 + Fe FeS04 + Cu d)2Fe +ЗС122FeCI3 Какая из этих реакций является окислительно-восстановительной и почему?
Составьте график формулы реакции и укажите окислители и восстановители. 20.Показано следующее уравнение реакции. а)Zn-f C12 — * — ZnCl2 b)Zn +2HC1ZriClj + H2f Первое и второе уравнения реакции указывают на окислитель. 21.Рассмотрим схему уравнения реакции: а)CuS 4-HN03 — * — Cu (N03) 2 + S + NO + H20 sc б) K2S03 + H2S04 + KMn04 K2S04 + MnS04 + … Используйте рекомендации на стр. 16 для создания окислительно-восстановительного уравнения.
- 22.Какие виды солей гидролизуются и почему? Опишите это на примерах нитрата цинка, сульфата калия и сульфида натрия. 23.Нарисуйте и заполните таблицу в блокноте (см. таблицу на стр. 20). 1.При длительном нагревании кристаллогидрата сульфата магния 12,3 г его масса уменьшается на 6,3 г. на основании этих данных определяется химическая формула этого кристаллогидрата.
2.Рассчитайте количество граммов бромид-ионов, которые человек получает в организм, если он принимает 15 мл препарата.100 мл содержит 2 г бромида калия и 2 г бромида натрия. 3.Нейтрализовать азотную кислоту * расходуемый раствор 400 г
Формула реакции, объясняющая изменение цвета индикатора цвета водного раствора соли Лакмус, метил, апельсин, фенол, фталеин. Людмила Фирмаль
Хлористый цинк Углекислый калий Сульфат натрия 0,12 массовой доли, или раствор 12 мл, содержащий 150% гидроксида калия (Р = 1,1 г / см3).Рассчитайте массовую долю и процентное содержание азотной кислоты в растворе. 4.In в раствор, содержащий 40 г медного купороса (II), кладем 10 г железного порошка. Какие вещества и сколько их будет после реакции?
5. Сколько миллилитров серной кислоты (o = −9.19 г / см3) требуется для реакции с алюминием? 6. Добавляли 0,05 мас. ч. или раствор, содержащий 5% сульфата железа (II) 20 г, 0,08 мас. ч. или 8% раствор, содержащий 20 г гидроксида натрия. Рассчитайте массу образовавшегося осадка. Лабораторные опыты Реакция с образованием осадка. Налейте 3-4 мл раствора сульфата меди (II) в 1 пробирку.
Второе-такое же количество раствора хлорида кальция, а третье-алюминия sulfate. In в первую пробирку добавляют небольшое количество раствора гидроксида натрия, во 2-ю-раствор натрия с ортофосфатом, в 3-ю-раствор нитрата бария. Все пробирки образуют осадок. Задача. Создайте уравнения реакций в виде молекул, ионов и укороченных ионов.
Объясните, почему образовались осадки. Можно ли добавлять другие вещества во все пробирки для осаждения? Создайте уравнения для этих реакций в виде молекул, ионов и укороченных ионов. Газовая реакция. 3-4 мл раствора сульфита натрия заливают в 1 пробирку, и такое же количество раствора карбоната натрия заливают во 2-ю пробирку. Добавьте как можно больше серной кислоты к каждому из них. them.
In в первой пробирке выделяются газы с резким запахом, а во второй-газы без запаха. Задача. Создайте уравнения реакций в виде молекул, ионов и укороченных ионов. Подумайте о том, какие другие кислоты могут воздействовать на эти растворы для достижения аналогичных результатов. Создайте уравнения для этих реакций в виде молекул, ионов и укороченных ионов.
Реакция с образованием слабо диссоциированного вещества. Налейте 3-4 мл раствора гидроксида натрия в 1 пробирку и добавьте 2-3 капли фенолфталеина. Решение будет багровым. Затем заливают раствором соляной или серной кислоты до обесцвечивания. Налейте около 10 мл медного купороса (II) в другую пробирку и добавьте небольшое количество раствора гидроксида натрия.
Образовался гидроксидный синий осадок. И медь (II).Налейте кислую кислоту в трубку, пока осадок не растворится. Задача. Создавайте уравнения реакций в виде молекул, ионов и укороченных молекул. ions. It объясняет, почему обесцвечивание произошло в первой пробирке и осадок растворился во второй пробирке. Какие общие свойства имеют растворимые и нерастворимые основания? Проверьте индикатор раствора соли.
В отдельные пробирки наливают 2 мл нитрата цинка, сульфида калия (или натрия) и раствор хлорида кальция. Используя чистый стеклянный стержень, перенесите каплю каждого раствора на синюю и красную лакмусовую бумагу. Синяя лакмусовая бумажка становится красной из-за действия раствора нитрата цинка.
От раствора сульфида калия (или натрия) Красная лакмусовая бумажка становится синей, а от действия раствора хлорида кальция лакмусовая бумажка не меняет цвет. Задача. Нарисуйте таблицу в тетради(стр. 20), чтобы заполнить. Основываясь на опыте, объясните, в каких случаях реакция закончится. Практика 1 Решение экспериментальных задач.
I. налейте 1-2 мл концентрированной серной кислоты в пробирку и замочите часть цинка. Обратите внимание на скорость реакции. Переложите содержимое в другую пробирку с 5-10 мл воды. Изменилась ли скорость реакции? Создайте уравнения реакций в виде молекул, ионов и укороченных ионов, покажите и объясните переходы электронов. а) что такое окислитель в этой реакции. Б) как и почему скорость реакции изменяется при разбавлении.
2.It действует на кусочки цинка: а) разбавленная серная кислота; б) концентрированная серная кислота (слегка нагретая). Осторожно понюхайте запах газа, вытекающего из второй трубки. Составьте уравнение реакции и укажите окислитель в первом и во втором случае. 3.In раствор хлорида магния, следующий раствор непрерывно применяется. гидроксид натрия.
б)сульфат калия; в)карбонат натрия; г)нитрат цинка; г)ортофосфорнокислый калий; д) сульфид натрия. Создайте реакцию equation. It достигает конца в виде молекул, ионов и укороченных ионов. 4.Данный раствор: а) карбонат калия и соляная кислота. b) сульфид натрия и серная кислота; c)хлорид цинка и азотная кислота; g) сульфит натрия и серная кислота; d) сульфат меди (II) и соляная кислота.
Слейте эти растворы попарно, немного нагрейте, понюхайте осторожно, в этом случае реакция пойдет до конца и определите причину. Создайте соответствующие уравнения реакции в виде молекул, ионов и укороченных ионов. 5.Схема фактически выполняет показанную реакцию. а) са?* + Со |—• * CaC03 | б)S0f- + 2Н + — * С0?Т + Н20 C)он — + Н + -Н2О д)А1°-*-А13 ± д; Си2 * — * соединениях cu0 е)2Н ± > — Hjt
6.Проводят реакцию между следующими веществами: а) сероводородной водой и хлорированной водой. б) раствор йодида калия и хлорированной воды. в) соляная кислота и алюминий, г) концентрированная серная кислота и медь(при нагревании).Составьте уравнение для реакции и укажите переход электронов.
Что такое окислитель? Что такое восстановитель? 7.Используя раствор, который находится на столе, вы получите: а) гидроксид железа(III). Б) сульфид меди (II); в) оксид серы (IV); г) карбонат магния; д) свинец. Создайте соответствующие уравнения реакции в виде молекул, ионов и укороченных ионов.
Смотрите также:
