Оглавление:




Меркуриметрия
- Меркуртутный Основной реакцией измерения ртути является взаимодействие взаимодействия H * ‘1, + 2X «= HgX2 (11,1) Х является Cl ~. Br, SCN и другие ионы. Наиболее часто используемым рабочим раствором для измерения ртути является раствор нитрата ртути Hg (NO; i) 2.
- Какая концентрация установлена для титруемого раствора NaCl в результате титрования по реакции Hg ** + 2CI = HgCI » Равновесие при титровании хлорида раствором хлорида ртути (II) определяется концентрацией реагента и константой стабильности HgC ^. верт:. } — | Hg «? Icl» 1710 «-, мл! ‘ Давайте рассмотрим, как изменяется концентрация ионов и СГ. Титруйте с помощью 100,0 мл 0,1 М NaCl в 0,05 М Hg (NO {). «
Для простоты расчета мы предполагаем, что объем раствора постоянен и равен 100,0 мл. Людмила Фирмаль
Hinpai pi и Hg (NOj) 2 в растворе считаются полностью диссоциированными, как NaCl. В первой точке кривой титрования, если титрование еще не добавлено, (СI) = 0,10 моль / л и p CI = -log | CI I ~ 10,0 мл 0,05 М Hg (NO; ) в этом растворе 2 При расчете кривой титрования это равновесие является доминирующим в условиях титрования, поэтому мы ограничиваемся рассмотрением только процесса (11.1). HgCh r 0,05-10,0 / wm-центрирование —- x = 0,00o-dg и хлорид Ионы: [SG] = 0,1 -2 (0,005-x) = 0,09 + 2x.
Подставьте равновесную концентрацию в формулу для константы стабильности HgCl2 (11,2): {tw + 2xh «, J-, 0n и max < те x = (Hg2 + |. <= 3,6-10 моль моль / л. Другие точки на кривой титрования, которые рассчитываются таким же образом (Таблица 11.1). В эквивалентной точке решения присутствует только произведение HgCJ * и его ступенчатая диссоциация. Hgci2 «Hgci ++ a; x ,,,, -jHga ^ ‘ia i = <| ,: *> HgCl + Hg * 4 + CI; p „„. ,. -Я <1.4>
При расчете равновесия (11,3) * — | C1] = ■ Таблица 11.1 Изменения pHg с добавлением 0,05 М Hg (NO) .- К 100,0 мл 0,1 М NaCl Написал ici-iрС1 | НЦО, | | NC | rn » 50,0 5,0-10 2 1,3 0,025 5,9. Я) 12 .23 90,0 1,0-10-2,0 0,045 2,1 «. 10’10,58 99,0 1,0-10 «* 3,0 0,0145 2,9-10 • 8,54 99,9 1,0. U-4 4,0 0,04995 2,9-10 кГ, 1 PHG 6 6 W P / 4> 50 100 v (H9 (нс, Rns. 11.1. Кривая титрования 100,00 мл 0,1 М раствора NaCl 0,05 М Hg (NO,). x (1,310 H *), откуда ds = 1,8 • 10 »
Когда добавляют больше Hg (NOa) 2, реакция NKS1 + Hg2 + = 2 В результате равновесная концентрация ионов Hg * + несколько уменьшается по сравнению с 5,0-10-5, но рассчитывается простым разведением. Кривая титрования, созданная на основе этих данных, показана на рисунке. 11.1. Как видите, внезапное изменение концентрации ионов ртути происходит в области точки эквивалентности.
То есть наблюдается скачок титрования. Величина скачка титрования зависит от константы устойчивости образованного комплекса и концентрации реагента. Поскольку реакция образования HgCb является экзотермической, скачки титрования уменьшаются с увеличением температуры и константы стабильности HgClo.
- Стабильность комплексов бромида ртути намного выше, чем у хлорида (lgPilKR, –9,05; lgPMRBr, 17,33), поэтому скачок титрования при измерении бромид-ионов больше, чем у хлорид-ионов. вы. При уменьшении концентрации хлорида или бромида скачок титрования уменьшается. Эквивалентность можно определить с помощью индикатора.
Метод измерения ртути стал широко использоваться в анализе после введения белого кристаллического осадка Hg [нитропруссид натрия N02 | Fe (CN) .sNO], который образует Fe (CN) sNOj (PR = 1). Это было 0,10 «9). Основным преимуществом нитропруссида является то, что он может напрямую измерять хлорид с помощью этого показателя в сильнокислой среде.
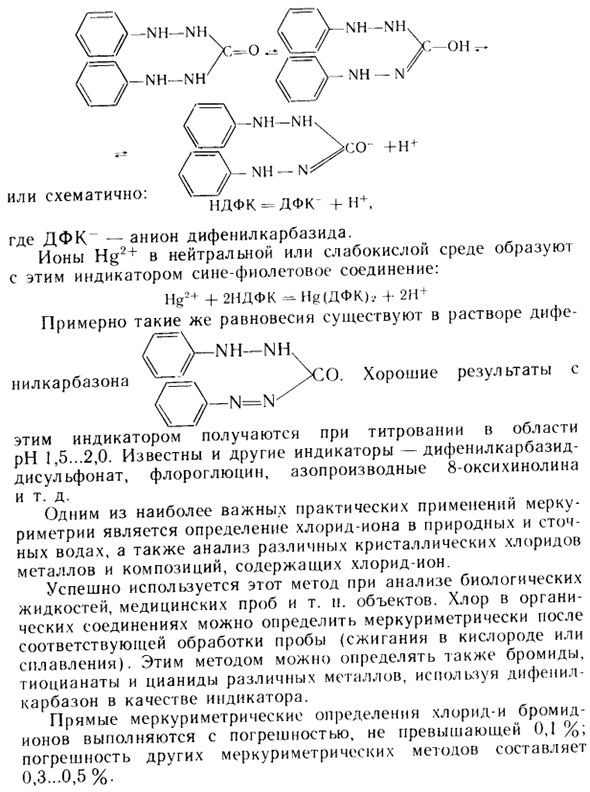
Дифенилкарбазид и дифенилкарбазон были эффективными показателями измерения ртути. Людмила Фирмаль
Эти вещества являются слабыми кислотами и действуют как кислотно-основные показатели в растворе. Раствор дифенилкарбазида имеет равновесие = (HgCl +]. A | HgCI2 | = = 0,05-x и присваиваем эти значения ступенчатому уравнению константы устойчивости.
0,05-х л 1 фунт-р- = 3,0-10, поэтому х = = 1,3-равновесие (11,4), x = [Hg2 + |; [C1 ~ | = = 1,3-10 ~ 4 + jt и (HgCl + l = 1,3’10 «4-x и константа устойчивости Заменить: = 5,5-106. 7 моль / л Или наброски: НДФК-ДФК + Н +, Где DFK представляет собой дифенилкарбазидный анион. Ионы Hg2 + в нейтральной или слабокислой среде образуют сине-фиолетовое соединение в этом индикаторе.
Hg * + + 2IDFK-N * (DFK) 4 4-2H + Почти такое же равновесие <Q-NH-NH-нилкарбазон / = \ XY. Хорошие результаты Этот показатель получают титрованием в диапазоне рН 1,5-2,0. Другими показателями также являются известные -дифенилкарбазид-диилфонат, флороглюцинол, азопроизводные 8-гидроксихинолина и др.
Одним из наиболее важных практических применений измерения ртути является измерение хлорид-ионов в природных и сточных водах, а также анализ композиций, содержащих различные кристаллические хлориды металлов и хлорид-ионы. Этот метод может использоваться для анализа таких объектов, как биологические жидкости и медицинские образцы.
Хлор в органических соединениях может быть измерен измерением ртути после правильной обработки образца (сжигание или синтез кислорода). Используя этот метод, различные бромиды, тиоцианаты и цианиды металлов также могут быть измерены с использованием дифенилкарбазона в качестве индикатора. Прямые измерения содержания хлорида и бромида ионов ртути выполняются с погрешностью не более 0,1%. Погрешность других ртутных методов составляет 0,3-0,5%.
Смотрите также:
Решение задач по аналитической химии
| Неводное титрование | Комплексонометрия (хелатометрия) |
| Общая оценка метода | Рабочие растворы |
