Оглавление:





Основные типы химической связи
- Основные виды химических связей Используя понятие электроотрицательности элементов, можно предсказать 3 основных случая химического взаимодействия между атомами. 1.Химические реакции происходят между атомами очень разных элементов электроотрицательности, таких как атомы щелочных металлов и атомы галогенов.
- 2.Химическая реакция происходит между атомами одного и того же электроотрицательного элемента. Такое взаимодействие наблюдается при образовании газов (H2, F2t, C12, O2, N2), в которых молекулы состоят из 2 одинаковых атомов. 3.Атомы могут подвергаться химическим реакциям, отличаться электроотрицательностью, но они не очень велики.
Этот случай является промежуточным между первыми двумя крайностями и особенно common. Людмила Фирмаль
An примером этого является образование молекул воды H20, хлористого водорода HCl, метана CH4 и многих других веществ. В зависимости от случая, к которому относится химическое взаимодействие этого элемента, выделяют определенные типы химических связей distinguished. It следует отметить, что между этими типами химических связей нет резких границ.
Между ними происходит постепенный взаимный переход. Таким образом, многие химические вещества имеют различные типы связей одновременно. Это связано с постепенным изменением электроотрицательности химического элемента. Ионные связи образуются при взаимодействии атомов элементов с очень разной электроотрицательностью(в первом случае), при этом происходит почти полный сдвиг электронного облака внешнего энергетического уровня от атома с низкой электроотрицательностью к атому с большой электроотрицательностью.
Атомы, которые почти полностью отказываются от внешних (валентных) электронов, превращаются в положительно заряженные ионы, а атомы, которые эти электроны приобретают, становятся отрицательно заряженными ионами. Ионы-это заряженные частицы, в которые атомы превращаются в результате отдачи или сцепления электронов.
Схематически процесс превращения атомов в ионы можно представить следующим образом: + nNa°2ё, 8ё, ё+ 9F 2ё,/ё-Na + F » или_ (Фторид натрия состоит из Иона натрия Na *и Иона фторида F〜). Из курса физики известно, что положительные и отрицательные заряженные частицы притягиваются друг к другу other. As в результате возникает взаимное притяжение между положительными и отрицательными ионами.
То есть образуются ионные химические связи. Химическая связь, которая возникает, когда некоторые атомы почти полностью покидают валентные электроны, а другие присоединяются к этим электронам, называется ионной связью. Соединение, которое будет образовано, называется ионным соединением. Наиболее типичная ионная связь возникает только между типичными металлами и галогенами.
Ковалентные связи образуются при взаимодействии атомов с одинаковой электроотрицательностью (2-й случай). Движение электронного облака не происходит. Поэтому в этом случае ионные связи образовываться не могут. Какова природа химической связи молекулы, состоящей из 2 одинаковых атомов? Чтобы ответить на этот вопрос, рассмотрим образование химических связей между атомами в молекулах водорода.
Уже известно, что атом водорода состоит из положительного ядра, вокруг которого расположено сферическое электронное облако. Поскольку электроны могут иметь различные (антипараллельные) спины, их облака перекрывают друг друга с образованием сильных электронных пар (которые связывают оба атома), как это происходит с атомами гелия(стр. 113).
Физический смысл этой связи можно объяснить процессом перекрытия и уплотнения электронного облака между положительными ядрами соединяющихся атомов. Химическая связь, возникающая в результате образования общей электронной пары (связи), называется ковалентной или атомной связью1. На рисунке 53 показана схема ковалентной химической связи в молекуле водорода, образованной α-электронным облаком overlap.
To Упрощение, это может быть показано следующим образом: Н — + — Н — > Н: Н Мы поговорим об этом методе более подробно, так как ковалентные химические связи очень часто выражаются с помощью общих связанных электронных пар (то есть с помощью так называемой электронной формулы).
Установлено, что при образовании многих молекул составляющие их атомы стремятся приобрести устойчивое расположение. 1. один электрон может образовать такую химическую связь. Эти примеры рассматриваются на курсах химии средней школы. Состоит из? 2 или 8 электронов, то есть от 1 электронной пары, такой как атомы гелия, или от 4 электронных пар, таких как атомы других редких gases.
In молекула водорода, каждый атом приобретает 1 устойчивую пару electrons. In в других случаях, когда образуется ковалентная связь, каждый атом приобретает устойчивое расположение, состоящее из 8 электронов. Исходя из этого, при составлении электронной формулы, они делают это: I. напишите вместе с химическим символом соответствующий атом. 2.Найдите группу периодических систем, в которой находится этот элемент.
3.Обратите внимание на количество валентных электронов в зависимости от группы, в которой этот элемент присутствует. 4.Используя точки, между атомами элементов существует так много общих электронных пар, что числа до 8 недостаточно. 5.Оставшиеся электроны обозначаются точкой вокруг химического символа каждого атома.
- Например, при использовании вышеуказанного подхода электронная формула для азота N2 будет иметь вид: 1.Затем напишите химический знак элемента азот. Н 2.Используя систему циклов, они обнаруживают, что азот находится в V группе основной подгруппы. 3.Периодическая система определяет, что в атоме азота имеется 5 внешних электронов. 4.It получается, что до стабильной конфигурации (то есть до 8 электронов) азоту не хватает 3 electrons.
So, между химическими символами азота с использованием точек будут показаны 3 электронные пары. н: н 5.Оставшиеся 2 электрона обозначены точками рядом с каждым атомом. 」. н: н:: Заметим, что изображение электрона точкой произвольно. Каждая точка представляет собой электронное облако определенной формы.
Сущность формирования спаренных пар электронов обусловлено перекрытием электронных облаков. Людмила Фирмаль
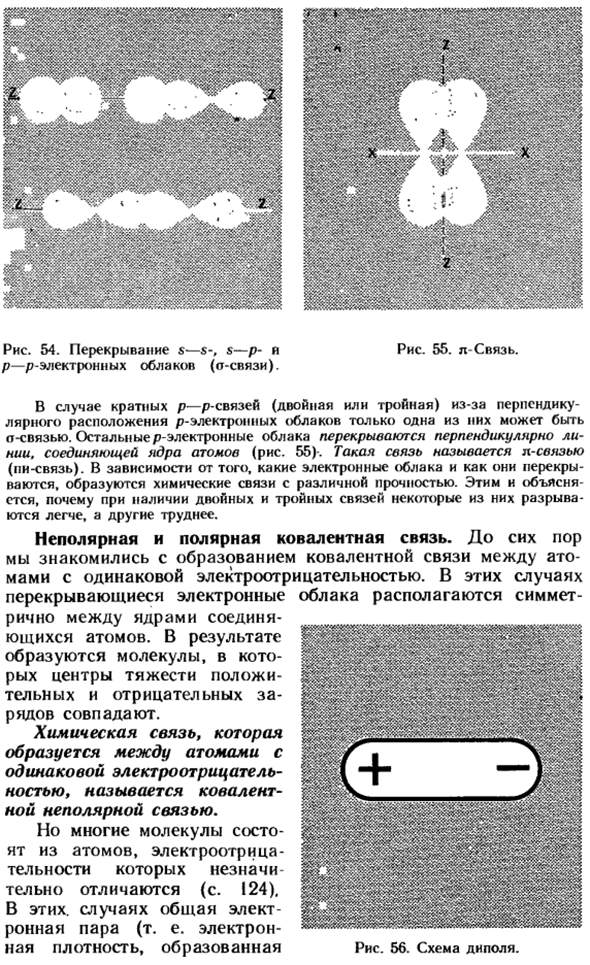
Пары электронов означает перекрытие ы — ы, с — П или р-п-электронного облака(рис. 54).Если электронное облако перекрывает Y вдоль линии, соединяющей 2 атомных центра (рис. 54), такая связь называется связью(Сигма-связью). Диаграмма 53.Образование ковалентных химических связей в молекулах водорода. 54.Дубликат ы-ы -с — п—а рис.55. л-связи. p-p электронное облако (o связь). Для нескольких p-p связей (двойных или тройных) P-электронные облака располагаются вертикально, поэтому только 1 из них будет<t связями.
Остальные электронные облака перекрываются перпендикулярно линиям. Соедините атомные ядра(рис. 55).Такая связь называется п-присоединиться(Пи-присоединяйтесь).В зависимости от того, какое электронное облако и как оно перекрывается, образуются химические связи различной интенсивности. Это объясняет, почему, когда есть двойные и тройные связи, некоторые из них ломаются легче, а другие становятся более трудными.
Неполярные и полярные ковалентные связи. Ещё нет. Мы были знакомы с образованием ковалентных связей между атомами с одинаковыми свойствами. electronegativity. In в этих случаях перекрывающиеся электронные облака располагаются симметрично между атомными ядрами соединяющихся атомов. atoms. As в результате образуется молекула, в которой центр тяжести положительных и отрицательных зарядов совпадает.
Химическая связь, образующаяся между атомами с одинаковой электроотрицательностью, называется ковалентной неполярной связью. Но многие молекулы состоят из атомов с несколько иной электроотрицательностью(с. 124).в этих случаях общая электронная пара(то есть электронная плотность, образованная рис. 56).Дипольная схема. 2 электронные облака, которые перекрываются) смещаются в сторону более электроотрицательных элементов. Например、 Н * + * CL: в—Н: сл:••••
Тогда в молекуле центр масс положительных и отрицательных зарядов не имеет match. In в той части молекулы, где находится элемент с высокой электроотрицательностью, накапливаются избыточные отрицательные заряды, а элемент с низкой электроотрицательностью-избыток положительных зарядов (рис.56).Такие молекулы называются полярными. Химическая связь, которая образуется между атомами с различной электроотрицательностью, но немного отличается, называется ковалентной полярной связью. В ответ на этот вопрос, упражнения 2-8 (стр. 134).
Смотрите также:
| Жизнь и деятельность Д. И. Менделеева | Кристаллические решетки |
| Электроотрицательность химических элементов | Окисление и восстановление |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
