Оглавление:






Расчет кинематического коэффициента диффузии на основе кинетической теории газов с учетом межмолекулярных сил взаимодействия.
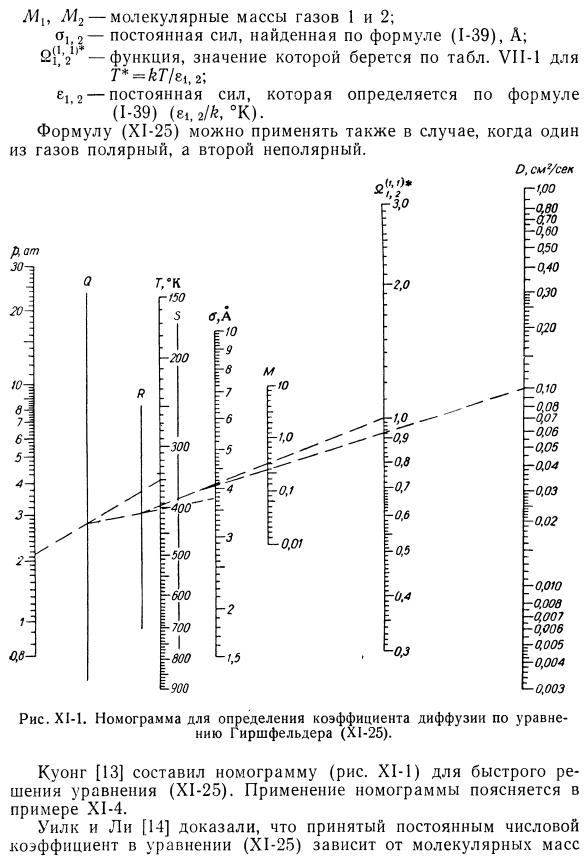
Расчет кинематического коэффициента диффузии на основе кинетической теории газов с учетом межмолекулярных сил взаимодействия. Теоретический расчет коэффициента диффузии требует постоянной силы o и значений e из уравнения Леннарда-Джонса(1-29). Метод расчета подробно рассмотрен Бердом, Хиршфельдером и Кертиссом[12]. Существует приближенная зависимость между диффузией 2 неполярных газов I и 2. (Х1-25) Где Oi2-коэффициент диффузии, а см2 / сек Р-давление, ам \ T-температура,°К. M1U M2-молекулярная масса газа I и 2. а]> 2-постоянная силы, определяемая по формуле (от 1 до 39), а; 2(11 ′ 21) * функция. Значения извлекаются в соответствии с таблицей. Т * -т / ги*, ВИ1-1 е, 2-силовая постоянная, определяемая по формуле (1-39)(е,.2Н ° К). Формула (X1-25) может также использоваться, когда один газ Полярный, а другой неполярный.
Куонг [13]отредактировал номограмму (рисунок X1-1) для быстрого решения уравнения (X1-25).Пример X1-4 показывает использование номограммы. Людмила Фирмаль
- Уилк и Ли [14]доказали, что численный коэффициент формулы (X1-25) константы зависит от молекулярной массы Коэффициент B является функцией значений M1 и M2:B = 0.00214-0.000492 (Х1-27) Диффузионный газ. Выражение принимает следующий вид: B7 ′ 3 / * / yi, 4-L42u / 2 (I, 1)* П°Я,2 ^ 1.2 mhm2. (Х1-26) Вводя переменную B в предыдущее уравнение, погрешность в расчете коэффициента диффузии уменьшается примерно вдвое. −0.74 / 0 (10DG / 6) (Х1-28) Значение функции yU / 21 *наиболее удобно интерполировать в соответствии с таблицей. ООН-1. Нин шин Чен [15]предложил уравнение, которое может определить эту функцию с высокой точностью(средняя ошибка составляет 0,078%). Где k-постоянная Больцмана. Е является постоянной силы. Нин шин Чен и отмер [16], основанные на Формуле (X1-28)и Формуле* /=1.276 Г° p9061(X1-29) (Х1-30) в *0.5894 у<sup class=»reg»>®</sup>400 * Мэриленд. После подстановки в уравнение (X1-25) и некоторых преобразований была получена зависимость. (Х1-31) Где Gcr-критическая температура,°К; Разум-это критическая масса крота. MCG.
- По мнению автора, формула (Х1-31) является более точной, чем формула (Х1-25). Более точное значение коэффициента диффузии TU дает формула: =(Х1-32) Где/ o-поправочный коэффициент, который был обнаружен. Для соответствующего значения T * = * kT / g, UN-2. * По мнению этих авторов, уравнения (X1-29) и (X1-30) дают более точные результаты, чем уравнения (1 * 33) и (1-34) Gnrschfelder. Да. 0.0026280 ro2a ^■> * 7 * 3. М. (Х1-33) Если происходит самодиффузия молекул газа в газ с приблизительно одинаковыми физическими свойствами(например, диффузия молекул Орто-водорода и пара-водорода), то формула (X1-25) имеет вид M1 = M2-m, o ^ e2 ar, 81 и коэффициент диффузии приблизительно равен.
В рассматриваемом случае существует также простая зависимость, следующая за выражением (UN-83). (Х1-34) Значение A * берется из таблицы. Для расчетного значения T * = kT / g, UN-2. Обратите внимание, что значение A *немного отличается в зависимости от температуры и близко к 1.1.Это означает связь, которая близко соответствует экспериментальным данным (критерии Шмидта: 5С = ш и 0.75(Х1-35) Введение поправочного коэффициента f0 для расчета коэффициента кинематической диффузии обычно не требуется, так как эта поправка очень мала.
Ибрагим и Кулур [17], в соответствии с формулой (Х1-35), установили, что модифицированный критерий Шмидта 5с ’=рУ»//) для диффузии различных газов в воздух линейно зависит от молекулярной массы м. (Х1-36) Эй, эй. / > 2 ″ 0.122 / −1.3 Где О2-кинематический коэффициент диффузии системы газ 1-воздух 2. Р-коэффициент динамической вязкости газа 1. Um-молярный объем газа 1; M-молекулярная масса газа1. Людмила Фирмаль
- Для полярных газов поправочный коэффициент должен быть введен в уравнение. Среднее отклонение расчетного значения от экспериментального значения составляет −7%. Рассмотрена зависимость коэффициента кинематической диффузии от температуры. На основе уравнений (XI-17) и (XI-18), полученных из основной кинетической теории газа, коэффициент диффузии газа равен Г в зависимости от температуры.{* 0Y] =0Λ ( ^ ) 3, r (X1-37) Здесь 0g. из 7 значение коэффициента диффузии при температурах Ti и Tg. Однако выражение (X1-37) лишь приблизительно отражает зависимость O от T. In по этой формуле вы получите лучший результат, если показатель 3 / g заменить на-I»8. °тг ° г、 В * 7 \ 4-с А, В. ^ 2 + с А, В. (Х1-38) Саарско рекомендует использовать формулу диффузии, по аналогии с вязкостью и теплопроводностью.
Где Cd, c-постоянная Сазерленда для пары газов A и B. °р = О.、 II Th. Ш Д(1. П. С. * Я… ^(Г.) (Х1-39) Формула Сазерленда гораздо точнее предыдущей и точно отражает зависимость E от T. значения SA, c рассчитываются по методу Арнольда(см. стр. 469).Используя формулы (X1-25) и(X1-32), Если известен коэффициент диффузии um при температуре 7U той же газовой пары, можно определить коэффициент Ot при температуре 7 * 2.In это дело: Где 2r, ’1} * значения функций, полученных из таблицы UN-1 для T1 и T2 (TX и Tg) соответственно. Значение является поправочным коэффициентом Он берется в соответствии с таблицей. Последний элемент up-3-Формулы (X1-34) Tx и 7 * 2-это отношение/ o коэффициента.
Смотрите также:
Методические указания по гидравлике
Возможно эти страницы вам будут полезны:
