Оглавление:


Результаты измерений кинематического коэффициента диффузии в газах.
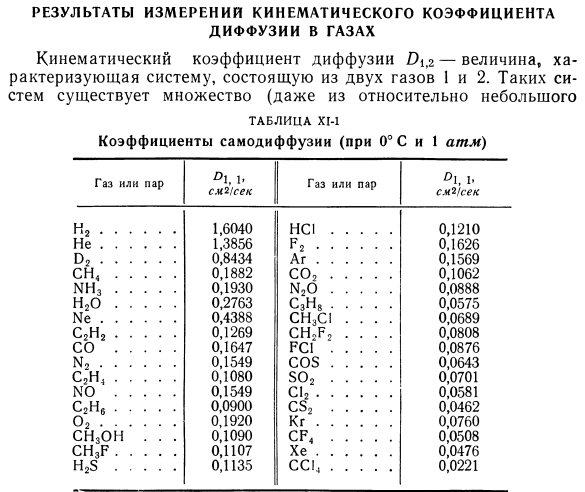
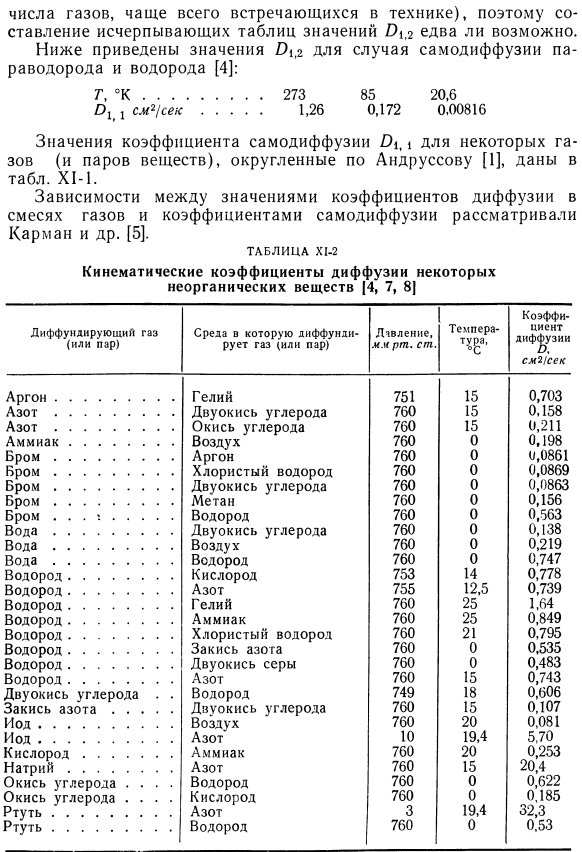
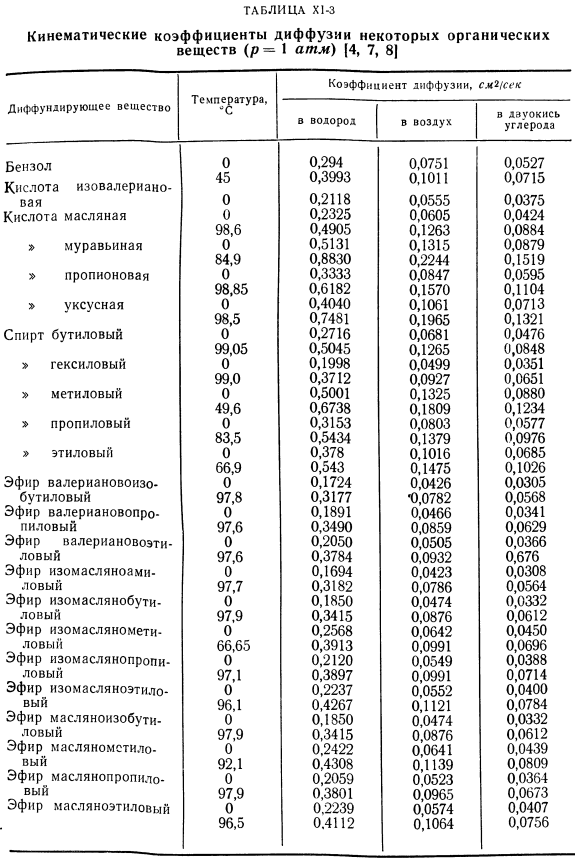
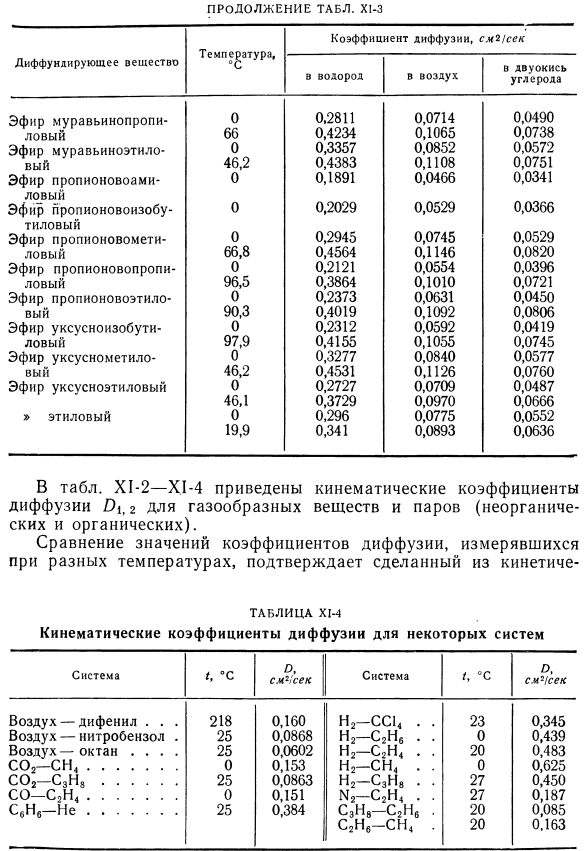
Результаты измерений кинематического коэффициента диффузии в газах. Коэффициент кинематической диффузии T> 1,2-это величина, характеризующая систему, состоящую из 2 газов, 1 и 2.Существует множество таких систем(относительно небольших Количество газов, наиболее часто встречающихся в технике), поэтому практически невозможно составить исчерпывающую таблицу со значением 0\$. Ниже приведены значения для самодиффузии пара-водорода и водорода. [4]: Т,°К 273 85 20,6 Оооо *!Секунд 1.26 0.172 0.00816 Значения коэффициента самодиффузии\некоторых газов (и паров вещества), округленные по Андрусову [1], приведены в таблице. Х1. Установлена зависимость между значением коэффициента диффузии газовой смеси и значением коэффициента самодиффузии Karman et al.[5]был рассмотрен: Внутри таблицы. X1-2-X1-4 показывает кинематический коэффициент диффузии D)1 (2 для газообразных веществ и паров (неорганических и органических).
Сравнение коэффициентов диффузии, измеренных при различных температурах подтверждает скорость реакции Согласно теории газов, делается вывод о том, что коэффициент диффузии увеличивается с увеличением температуры. Людмила Фирмаль
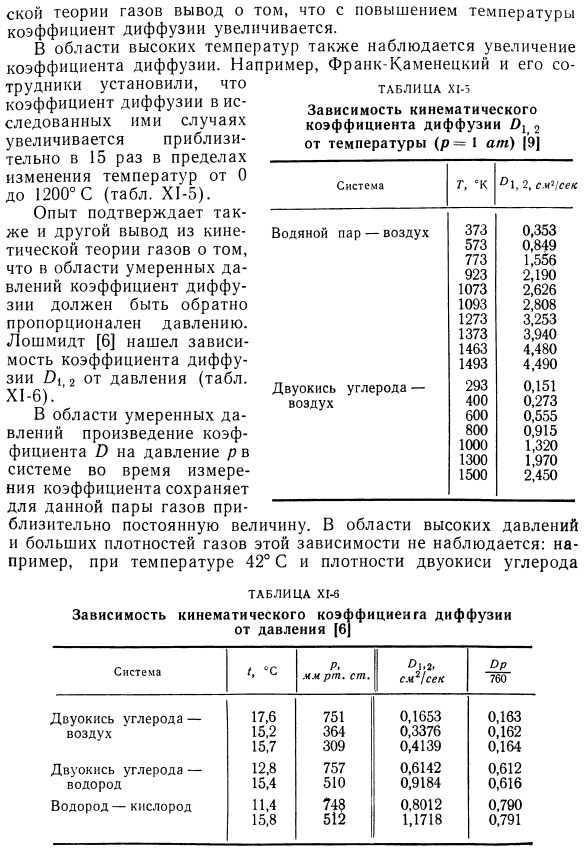
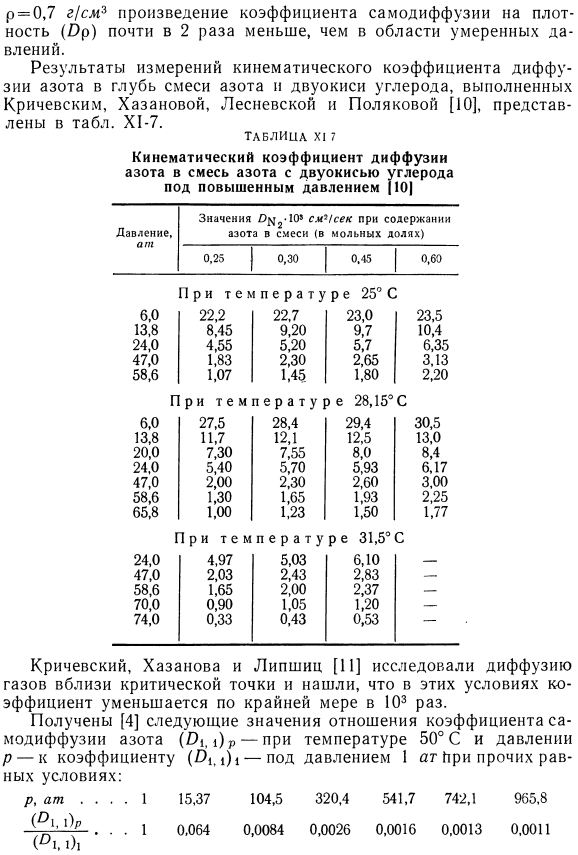
- При высоких температурах наблюдается также увеличение коэффициента диффузии. Например, Фрэнк каменецки и его Исследователями установлено, что коэффициент диффузии исследуемого случая увеличивается от 0 до 1200°С в интервале температур примерно в 15 раз (табл. х1-5). Из опыта, из кинетической теории газов подтвердился еще один вывод: в диапазоне давлений среды коэффициент диффузии должен быть обратно пропорционален давлению. Лошмидт [6] нашел зависимость давления от коэффициента диффузии Ox 2(табл. Х1-6). В диапазоне средних давлений коэффициент O и произведение давления в системе во время измерения коэффициента поддерживают приблизительно постоянные значения для конкретного газа pair. In в области высокого давления и высокой плотности газа эта зависимость не наблюдается: например, при температуре 42°С и плотности углекислого газа Р = 0,7 г! произведение cmb, коэффициента самодиффузии и плотности (Op) почти в 2 раза больше, чем в диапазоне средних давлений.
- Результаты измерений кинематического коэффициента диффузии азота в смесь азота и углекислого газа, проведенных Кричевским, Хазановой, Лесневской, Поляковой [10], представлены в таблице. Х1-7. Кричевский, Хазанова, Липшиц [11]исследовали диффузию газов вблизи критической точки и установили, что в этих условиях коэффициент уменьшается не менее чем в 103 раза. При коэффициенте самодиффузии азота (0|, Op-температура 50°С и давление p (04.4)4-давление 1 Атри, при прочих равных условиях, получают следующие значения[4]: Из представленных данных видно, что зависимость Op = sogY справедлива только в диапазоне средних давлений. Следует обратить внимание на высокое значение коэффициента диффузии в системах, содержащих низкомолекулярные газы (водород, гелий).
Это согласуется с выводами кинетической теории газа. Уравнение(X1-22)-(X1-24). Людмила Фирмаль
- Мы нашли гелий, аргон, согласно Германии[4]: Рассмотрен случай диффузии в бинарных системах, когда первый компонент глубоко диффундировал в фазу второго компонента, который содержал небольшое количество первого компонента. Если фаза, на глубину которой диффундирует 1-й компонент, содержит значительное количество, то величина коэффициента диффузии зависит от состава этой смеси. Например, в системе водород (1-й компонент) углекислый газ (2-й компонент) Таким образом, влияние состава фазы, в которой происходит диффузия, невелико относительно коэффициента 2(обычно разница не превышает 8%). При диффузии азота в смесь азота и углекислого газа в диапазоне высоких давлений наблюдается, что изменение состава газовой фазы оказывает существенное влияние на коэффициент диффузии(см. таблицу Х1-7).
Смотрите также:
Методические указания по гидравлике
Возможно эти страницы вам будут полезны:
