Оглавление:



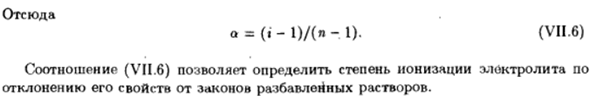

Электролитическая ионизация. Степень и константа ионизации
- Электролитическая ионизация. Степень и константа ionization. To исследование Разбавленный раствор обладает всеми их общими свойствами (понижением давления Изменения пара, температуры замерзания и кипения, осмотического давления Давление) изменяется пропорционально количеству растворенных частиц. Такое свойство называется множеством.
- И это общая закономерность Растворы органических веществ в воде и Органический solvents. In исследование водных растворов солей, кислот、 Было установлено, что причина зависит от соответствующего изменения свойства Значительно превышает ожидаемое значение концентрации раствора. 、 Почти в 2 раза выше криогенной константы воды с, 36° 1.86°).Это число частиц в водном растворе кислоты、 Основания и соли не соответствуют молярной концентрации раствора.
Например, понижение температуры замерзания молярного раствора NaCl Людмила Фирмаль
Кроме того, раствор характеризуется отклонением от закона разбавления ленных решений、 Из водного раствора некоторых органических веществ. Это и есть мозг. Объясните наличие заряженных частиц в растворе. Вещество, раствор(или Расплав, проводящий ток) назывался электролитом. Рассмотрены и обобщены свойства раствора электролита Теория электролитической ионизации Аррениуса A887) называется、
Я основывался на химической теории раствора. А. каблуков, В. А. стенограмма Кистяковского Д. И. Менделеева. Основные положения теории электролитической ионизации: 1) происходит растворение солей, кислот и оснований в воде Образование заряженных частиц и из этих веществ-катионов и Отрицательный ион;
2) электропроводность водного раствора соли, кислоты, основания Она пропорциональна общей концентрации ионов в растворе. Электролитическая ионизация обусловлена взаимодействием полярностей Растворитель Кул, содержащий частицы растворимых веществ. Это взаимодействие Например, следующие результаты в основном даже поляризации ковалентных связей В хлористом водороде.
Когда этот газ растворяется в воде、 Ионы водорода и хлора вследствие ослабления связи H-C1 в больших средах Электрическая постоянная. Переход ионов в растворы сопровождается гидратацией- Около: НС1+иН2О* = Н НгО^) +С1-(Н2О)П-* Сто пятьдесят два Такой же процесс наблюдается в основном при растворении ионов Кристаллы в воде (например, NaCl).В кристаллической решетке нет ионов Однако взаимодействие Na +и SG с полярными молекулами растворителя Поляризация связей внутри кристалла способствует его ослаблению и、
Переход частиц в растворы обусловлен образованием гидратированных ионов: NaCl +и Н2О* = * Na +(H2O) X +С1-(Н2О)» — I Процесс гидратации очень пирогенный、 Низкая энтальпия. Обычно степень гидратации, то есть количество молекул растворителя Каждый ион, заключающий его, очень велик(n и x-целые числа, n> 1, x> 1); только Во время кислотной ионизации (x = 1): HA + nH2O?=±Н3О+ +А — (Н2О)»-、
Это объясняется малым размером ионов водорода (протонов). — Размер атома 10-4.Во время гидратации протоны вводятся в шар молекул Н2ОЩО * с образованием ионов гидроксония. Образуется новая ковалентная связь Пара свободных электронов кислоты по донорно-акцепторному механизму Он добрый и насыщенный. 1. количественные характеристики электролитической ионизации Степень ионизации и определяется как процент ионизации Молекулы * общее количество растворенных молекул.
- Обычно степень ионизации Он выражается в процентах или процентах от единицы измерения. а =(я / yaoI00, и (VII. Два) Где i-число частиц, подвергающихся электролитической ионизации. ЯО-это число Растворенные частицы. В зависимости от степени ионизации электролит является условно сильным (а> 30%) и слабый (а <3%).Степень ионизации зависит от природы раствора. Тело.
Более полярные молекулы растворителя, при прочих равных условиях Степень ионизации растворенного вещества будет выше. Электролиз Ионизация сопровождается тепловым эффектом, степень ионизации равна Температура, и температурные эффекты могут быть оценены на основе Le Chateau Тело: когда электролитическая ионизация эндотермична
Процесс, то, когда температура повышается, степень ионизации увеличивается и уменьшается Температура упадет. Людмила Фирмаль
Это сильно влияет на степень и концентрацию электролитической ионизации Ворье. Если рассматривать электролитическую ионизацию как равновесие Быстрый химический процесс Ка + uH2O?= Б к ^ СПЧ)* + а-(Н2О) Затем, согласно принципу сдвига равновесия, разбавление водой будет увеличиваться Число Диссоциированных * * молекул, то есть степень ионизации при разбавлении Лень на подъеме. * Для веществ с немолекулярной структурой-вычислительная единица. **
Необходимо различать термическую диссоциацию, протекающую в зависимости от гемолиза Механизмы (например, NH4CI ^ = ^ NH3 + HO) и электролитическая диссоциация (ионы (NH4C1=?= * / NH * + SG). .153. Процесс электролитической ионизации характеризуется постоянной более удобным Ионизация путем применения закона химического равновесия к it. So, для реакции CA ’^ K + + A » константа ионизации Ки=. [К *] [А -] / [КА].
Концентрация моля в скобках показана ниже ponents. In в отличие от степени ионизации, константы электролитической ионизации являются Это зависит только от природы и температуры электролита. Более высокая стоимость Да, электролит сильный. Между константой и степенью электролитической Существует количественная связь с ионизацией. Конечно.
В этом процессе общая концентрация растворенного вещества KA равна s, а порядок Ионизация равна A. тогда[K +] = [A»] = ac, таким образом、 Связанных частиц[ка] = а-в) с. замена значений переменного тока и-А) с Уравнение для константы ионизации、 г、_ АСА. (VII Устава. Три) Соотношение (VII. 3) называется методом разбавления Оствальда.
Для слабых Для электролита,<1, Кк » а2с. Отсюда Или (VII. четыре) Где V-1 / s-разбавление. Формула (VII. 4) ОТ и для разбавления Раствор в 100 раз, а степень ионизации-в 10 раз. Учитывая степень электролитической ионизации, закон может быть применен Вводят коррекцию, разбавляют раствор и раствор электролита Этот фактор называется коэффициентом изотонического вангова.
И затем… Отношение аналогичных свойств к агрегационной характеристике электролита Раствор неэлектролита той же концентрации равен коэффициенту Ван Гога、 Иначе говоря АР/ АП = а ^ с / ДТЗ = ATJATK = piJVocu = я ’ (VII Устава. Пять) Очевидно, что в растворе электролита всегда r> 1, в растворе неэлектролита Лоритов 1 = 1. Изотонические коэффициенты могут быть связаны со степенью ионизации.
Пусть будет так Степень ионизации некоторых электролитов и общее количество молекул в растворе при диссоциации равной а, каждая молекула электролита распад Н-ионов. Затем количество молекул электролита распадается на ионы、 Равно ac, число ионов в растворе, проходящих через него, и число молекул, которые не распадаются Ион,-А-А) С. общее число частиц в растворе равно А-А) s + pass.
Отношение общего числа частиц в растворе к числу растворенных молекул рассчитывается заранее Является изотоническим коэффициентом С А-а + па)•1/ ч Т= -’:, » = 1-АА-Н). Сто пятьдесят четыре Отсюда а = (, ’ −1)/(Я-1). (VII Устава. Шесть) Соотношение (VII. 6) позволяет определить степень ионизации электролита. Отклонение свойств от закона разбавленных растворов.
Смотрите также:
| Процесс образования растворов | Понятие о теории сильных электролитов. Активность |
| Идеальный раствор. Законы разбавленных растворов | Кислотно-основная ионизация |
